やさしく解説:α-シクロデキストリン“ポリマー” — 糸通しで強く、光で動く【日本語版】
作成日:2025-10-26 / 対象:一般向け解説
まずは1分で
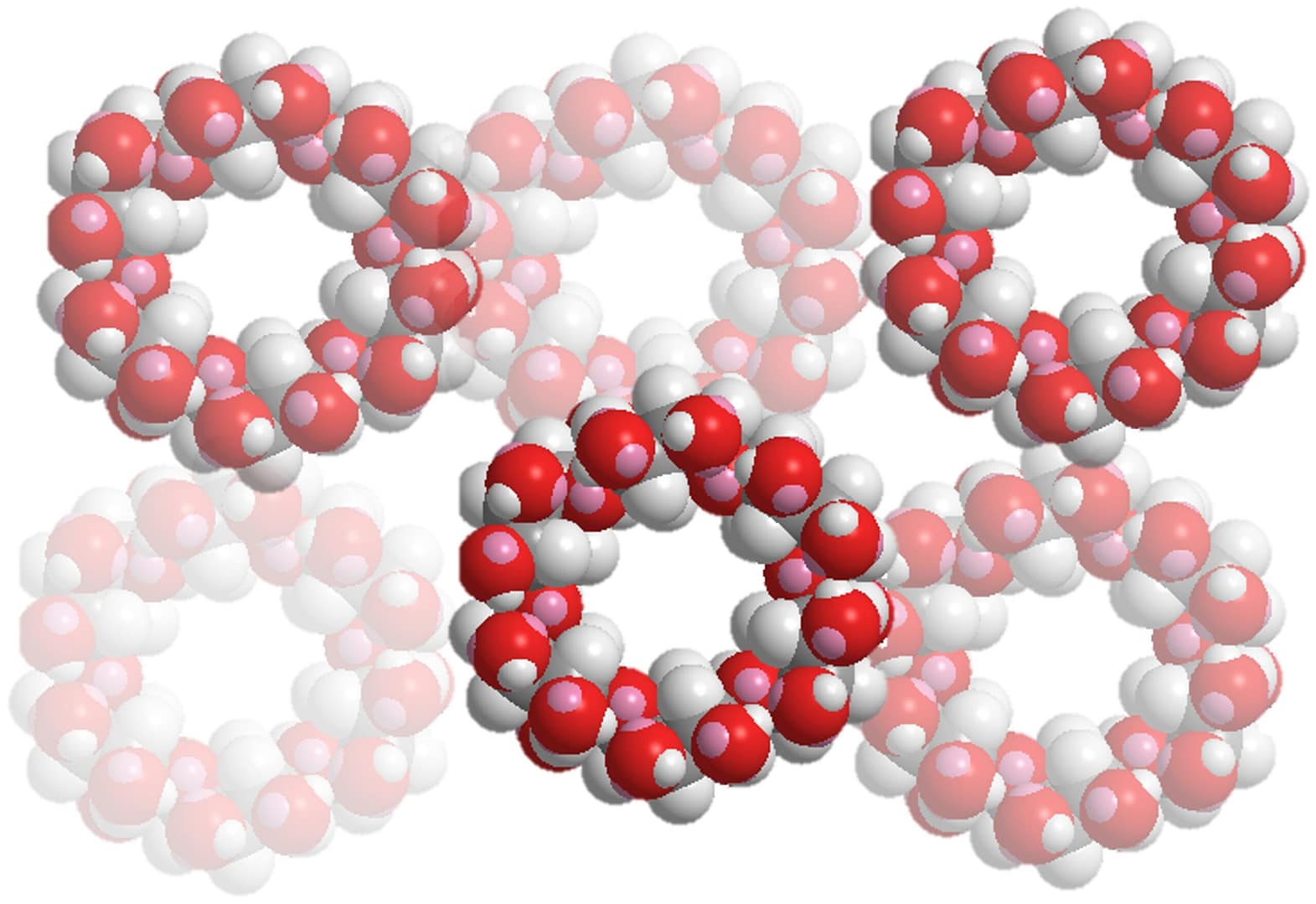
- α-シクロデキストリン(α-CD)は、内側が“油になじむ”小さな空洞をもつ分子の輪。
- この輪に高分子の糸(PEGなど)を糸通しすると、スライド自在の結び目(ポリロタキサン)ができます。ここから弾性が高く壊れにくいゲルや、光で曲がるアクチュエータ、医療向けのスマート運び屋(ドラッグデリバリー)が生まれます。
仕組み(やさしく)
- 物理架橋(包接):α-CDの輪がポリマー鎖を“つかむ”ことで、切れずに滑る結び目になります。これが衝撃を吸収し、高い伸びや自己回復を生みます。
- 化学架橋を足す:光や化学反応で化学的な橋も加えると、強さとタフさが両立した二重ネットワークができます。
- 機能分子をのせる:輪と糸の間に**光で形が変わる分子(アゾベンゼン等)や薬の“前駆体”**を入れると、光で曲がる/色が変わる/薬を放すなど、用途が広がります。
代表例(3シーンで理解)
1) 光でサッと曲がる「分子筋肉」
何?
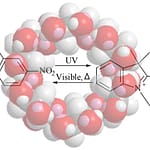
α-CDを“輪”、光スイッチのアゾベンゼンを“留め具”にした**[c2]デイジーチェーンを骨格に、ポリマー同士を架橋。乾いた薄片(キセロゲル)は紫外光で毎秒7°も素早く曲がる**“分子アクチュエータ”になります。
なぜすごい?
輪が糸の上をすべるので、分子レベルのストロークがマクロな曲げ仕事に変換されます。
用途の芽:微小バルブ、光駆動の把持アーム、ソフトロボ。
キーワード:デイジーチェーン、ロタキサン、光応答ポリマー。
2) バイオフィルムに突入する「スマート運び屋」
何?
α-CDに光感受性色素(Ce6)や一酸化窒素(NO)前駆体をホスト—ゲストで載せ、pHで表面電荷が反転するブロック共重合体に組み込むと、酸性のバイオフィルムへするっと侵入。中ではグルタチオン(GSH)に反応してNOを放出し、光線力学療法(PDT)を相乗強化します。
なぜすごい?
NOが低酸素の緩和やRNS生成にも効き、低用量・低照射でも高い殺菌性能を示します。
用途の芽:難治感染(MRSAなど)の表面治療、低侵襲な局所治療。
キーワード:電荷反転、GSH応答、NO×PDTシナジー。
3) がん治療を“増幅”するNOナノジェネレータ
何?
α-CD由来のS-ニトロソチオールや光色素をレゴのように組み替え、腫瘍の低酸素を緩和しつつ細胞内GSHを枯渇、さらにNO×ROS→RNSで光治療効果を増幅する超分子ナノ発生器。
なぜすごい?
複数の弱い効果を空間・時間で重ねる戦略で、副作用を抑えつつ効きを底上げ。
用途の芽:局所PDTの高効率化、併用療法の設計。
キーワード:包括組み立て、ホスト—ゲスト、相乗療法。
よくある質問(FAQ)
Q1. α/β/γ どれを使う?
→ 輪の内径で選びます。細い鎖や小分子なら α-CD、大きめなら β/γ-CD を検討。
Q2. どこが普通の高分子と違う?
→ “切れないけど滑る結び目”を作れる点。これが高い破断伸びと疲労耐性、素早い光応答につながります。
Q3. 医療応用は安全?
→ 材料・用量・投与部位に依存。CDは医薬・食品で広く評価あり。グレードと放出設計が重要です。
参考文献(DOIリンク)
- Fast response dry-type artificial molecular muscles with [c2]daisy chains(光で素早く曲がる分子アクチュエータ)
https://doi.org/10.1038/nchem.2513 - Surface charge switchable supramolecular nanocarriers for NO–PDT biofilm eradication(電荷反転ナノキャリアでバイオフィルム攻略)
https://doi.org/10.1021/acsnano.9b05493 - Nitric oxide as an all-rounder for enhanced photodynamic therapy(NOで光治療を多面的に増強)
https://doi.org/10.1016/j.biomaterials.2018.09.043
Gentle Guide: Alpha-Cyclodextrin “Polymers” — Slide, Strength, and Light-Driven Motion【English Version】
Updated: 2025-10-26 / For general readers
In one minute
- α-Cyclodextrin (α-CD) rings can thread polymer chains to build polyrotaxanes—slidable, noncovalent “knots”.
- From that motif arise tough hydrogels, light-bending actuators, and smart nanocarriers for healthcare.
How it works (plain language)
- Physical inclusion crosslinks: α-CD rings grip the chain yet slide, dissipating stress → stretchable, fatigue-resistant networks.
- Add covalent links to form dual networks for strength + toughness.
- Load functions (azobenzene switches, NO prodrugs, photosensitizers) via host–guest to get light motion, color/fluorescence change, or theranostic delivery.
Three snapshots
1) Light-driven “molecular muscles”
A [c2] daisy-chain (α-CD ring + azobenzene stopper) crosslinked polymer bends rapidly under UV (≈7°/s in dry films). Slidable rings turn molecular strokes into macroscopic work (micro-valves, optical grippers).
2) Biofilm-penetrating smart carriers
α-CD hosts Ce6 and NO prodrugs on a pH-switchable block copolymer: charge reversal at pH 5.5 drives deep penetration into acidic biofilms, then GSH-triggered NO release boosts photodynamic therapy at lower doses/irradiance.
3) NO as an “amplifier” for PDT
α-CD-derived constructs can relieve hypoxia, deplete intracellular GSH, and convert NO + ROS → RNS, amplifying photodynamic effects with modular, LEGO-like assembly.
FAQ
α vs β vs γ?
Choose by cavity size (smaller guests favor α-CD).
Why better than conventional gels?
The sliding crosslinks provide high elongation and fatigue tolerance without sacrificing strength.
Any caveats?
Biocompatibility depends on grade/dose/route; tune release profiles and surface chemistry for the use case.
References (DOI)
- https://doi.org/10.1038/nchem.2513
- https://doi.org/10.1021/acsnano.9b05493
- https://doi.org/10.1016/j.biomaterials.2018.09.043